
Wirusy to małe cząstki zakaźne, które infekują praktycznie wszystkie formy życia. Nie mają struktury komórkowej i nie potrafią się rozmnażać bez komórki gospodarza.
Ich budowa jest prosta: genom (RNA lub DNA) i kapsyd. Dojrzała cząstka nazywa się wirion.
Ta sekcja wprowadza podstawy: co to są wirusy, jak działają i dlaczego dominują w biosferze. Przyjrzymy się też sposobowi ich oddziaływania z organizmami żywymi.
W dalszej części przewodnika znajdziesz rzetelne informacje o cyklu życiowym, klasyfikacji oraz praktycznych zastosowaniach w medycynie i inżynierii. To kompendium od definicji po zaawansowane wykorzystanie.
Najważniejsze wnioski
- Wprowadzenie do pojęcia i budowy wirusów oraz roli wirionu.
- Wyjaśnienie, dlaczego potrzebują komórki gospodarza do namnażania.
- Skala: wirusów jest ogromnie dużo i występują w każdej niszy ekologicznej.
- Rodzaj materiału genetycznego wpływa na identyfikację i terapie.
- Przewodnik prowadzi od podstaw biologii po zastosowania w biotechnologii.
Czytaj także: Most Golden Gate – symbol inżynierii i odwagi: historia mostu
Cel przewodnika i intencja użytkownika: od definicji wirusa po zastosowania w biologii i medycynie
Celem tego przewodnika jest zestawienie rzetelnych informacje — od podstawowych definicji po praktyczne zastosowania w medycynie. Tekst ma pomóc w zrozumieniu, jak wirusy są opisywane w nauce i jakie konsekwencje niesie ta wiedza.
Przewodnik jest przeznaczony dla studentów, specjalistów oraz osób zainteresowanych aktualnymi badania i wdrożeniami. Znajdziesz tu klarowne wyjaśnienia terminów oraz praktyczne przykłady użycia wiedzy w diagnostyce i terapii.
Struktura artykułu obejmuje część o podstawach biologii, sekcję o ryzykach i zabezpieczeniach oraz fragment poświęcony zastosowaniom w biologii molekularnej. Opiszemy też, w jaki sposób poznane mechanizmy mogą prowadzić do nowych rozwiązań klinicznych.
- Co zyskasz: kluczowe pojęcia i kontekst praktyczny.
- Przykłady z badań i studia przypadków.
- Praktyczne wskazówki dla planowania eksperymentów w zakresie terapii i biotechnologii.
„Priorytetem jest wiarygodność i aktualność treści, przedstawiona w jasny i użyteczny sposób.”
Wirusy jako byty biologiczne: podstawowa charakterystyka i rola w ekosystemach
Cząstki te działają jako bezwzględni pasożyci wewnątrz komórek, całkowicie zależni od maszynerii gospodarza. Nie mają organelli ani metabolizmu, a najprostsze składają się z genomu (RNA lub DNA) i kapsydu.
To uzależnienie od komórki wyjaśnia, dlaczego klasyfikacja życia budzi kontrowersje. Brak samodzielnych układów metabolicznych odcina drogę do niezależnego rozmnażania.
Są obecne niemal we wszystkich niszach — od oceanów po gleby i środowiska ekstremalne. Liczba tych cząstek przewyższa liczbę bakterii co najmniej dziesięciokrotnie, co ma konsekwencje dla obiegu pierwiastków i kontroli populacji mikroorganizmów.
Wewnątrzkomórkowi pasożyci bezwzględni a definicja życia
Ich zależność od komórki gospodarza kwestionuje granicę między biochemią a biologią. Mimo braku komórkowej organizacji, te byty mają geny i podlegają ewolucji.
Skala zjawiska: liczebność, wirom człowieka i różnorodność nisz
W ludzkim organizmie występują ogromne stężenia — w jelitach szacuje się 10^9–10^15 cząstek na gram, a na skórze ok. 10^6 na cm².
- Różnorodność: wirom człowieka zmienia się z wiekiem, dietą i stanem immunologicznym.
- Rola ekologiczna: wpływają na dynamikę organizmów żywych i stabilność mikrobiomów.
Budowa wirusów: kapsyd, nukleokapsyd, osłonka lipidowa i wypustki glikoproteinowe
Architektura wirionu warunkuje jego zdolność przetrwania i zakażania gospodarza. Dojrzała cząstka składa się z genomu (RNA lub DNA) osłoniętego kapsydem zbudowanym z kapsomerów i protomerów. Kompleks genomu z białkami nazywamy nukleokapsydem.
Niektóre cząstki mogą mieć dodatkową osłonkę lipidową pochodzącą z błony komórki gospodarza. Osłonka z peplomerami zastępuje białka gospodarza i ułatwia rozpoznanie receptorów.
- Różne typy symetrii: helikalna (np. wirus mozaiki tytoniu), ikozaedralna (np. adenowirusy) i złożona (np. pokswirusy).
- Bezotoczkowe vs otoczkowe: brak osłonki daje większą odporność na wysychanie i detergenty; osłonkowe łatwiej unikają odpowiedzi immunologicznej, ale są wrażliwsze w środowisku zewnętrznym.
- Rola białka M i peplomerów: białko macierzy łączy osłonkę z nukleokapsydem, a peplomery pośredniczą w przyłączaniu do receptorów.
Wypączkowanie to mechanizm, dzięki któremu potomne cząstki opuszczają komórkę bez jej lizy, co może sprzyjać przewlekłym zakażeniom. Taka architektura wpływa też na projektowanie wektorów i szczepionek.
Materiał genetyczny wirusów: DNA, RNA i efektywne pakowanie informacji
Genom każdej cząstki może przyjmować różne formy, które determinują strategię namnażania. Może mieć RNA lub DNA, jedno- lub dwuniciowe, liniowe lub koliste.
ssDNA, dsDNA, ssRNA (+/−), dsRNA i ambisens różnią się sposobem uruchamiania syntezy białek. RNA (+) działa często jak mRNA, podczas gdy RNA (−) wymaga najpierw syntezy komplementarnej nici.
Segmentacja genomu umożliwia reasortację cech i szybkie zmiany fenotypowe. Konkatamery i układy wielocząsteczkowe wpływają na pakowanie i mechanizmy replikacji dna u niektórych rodzin.
Sygnały regulacyjne i struktury wyższego rzędu, takie jak pętle i stem-loops, kierują inicjacją replikacji i przyciągają polimerazy. CHEMIA zasad w DNA i RNA determinuje stabilność i wierność kopiowania.
Skutki praktyczne: niektóre wirusy niosą własne polimerazy, inne korzystają z enzymów gospodarza. To wpływa na cele terapii przeciwwirusowej i sposób, w jaki gromadzone są informacje o procesach replikacji dna i mutacji.
Cykl życiowy wirusa: wnikanie do komórki gospodarza, ekspresja genów i składanie wirionów
Cykl zaczyna się od przyłączenia cząstki do odpowiedniego receptora na powierzchni komórki gospodarza.
Etapy infekcji to: adsorpcja, wniknięcie przez endocytozę lub fuzję, uwolnienie genomu, ekspresja wczesnych i późnych genów, replikacja oraz montaż nukleokapsydów.
Różnice między gospodarzami
U ludzi i zwierząt wiele wirusów wnika przez błony i wykorzystuje endocytozę lub bezpośrednią fuzję.
W przypadku roślin bariera ściany komórkowej wymaga uszkodzeń lub wektorów, które mogą przenosić materiał zakaźny.
Wykorzystanie maszynerii komórkowej
Podczas replikacji niektóre rodziny kopiują swoje genomy w cytoplazmie, inne korzystają z jądra komórkowego gospodarza.
Polimerazy gospodarza często inicjują transkrypcję, a enzymy wirusowe uzupełniają brakujące funkcje.
- Biosynteza białek: wirusowe białka kierowane są do błon, co ułatwia montaż.
- Uwalnianie: lizis, sekrecja lub wypączkowanie decydują o losie komórki i rozprzestrzenianiu.
Wybór ścieżek wejścia i wyjścia wpływa na tropizm tkankowy i wytycza cele terapii oraz przeciwciał neutralizujących.
Klasyfikacja ICTV i system Baltimore’a: jak porządkować różne typy wirusów
Dwa komplementarne systemy ułatwiają porządkowanie ogromnej różnorodności cząstek zakaźnych. ICTV stosuje hierarchię taksonomiczną, a Baltimore skupia się na strategii wytwarzania mRNA opartej na materiale genetycznym.
Rangi taksonomiczne
ICTV porządkuje grupy od realm przez filum, klasę, rodzinę, rodzaj aż po szczep. To pomaga ustalić relacje ewolucyjne i przypisać cechy fenotypowe.
Siedem klas Baltimore’a
System Baltimore dzieli organizmy na klasy w zależności od typu genomu i mechanizmu tworzenia mRNA. Ta klasyfikacja ułatwia przewidywanie reakcji na leki i projektowanie testów diagnostycznych.

„Połączenie obu systemów zwiększa trafność diagnozy i planowania terapii.”
| System | Podstawa | Przykładowe rodziny |
|---|---|---|
| ICTV | Taksonomia ewolucyjna | Herpesviridae, Potyviridae, Orthomyxoviridae |
| Baltimore | Mechanizm tworzenia mRNA | Class IV (ssRNA+): Picornaviridae; Class V (ssRNA−): Orthomyxoviridae |
| Praktyka kliniczna | Połączenie obu | Ułatwia diagnostykę i dobór terapii |
Wnioski: klasyfikacja pozwala porównać różne typy, wskazać cechy, które mają znaczenie diagnostyczne i wyjaśnić, jak przypadku wątpliwości decydują dane o genomie i replikacji.
Występowanie i wirom: obecność wirusów w organizmach i środowisku
Obecność cząstek zakaźnych obejmuje wszystkie komórkowe formy życia — rośliny, zwierzęta i mikroorganizmy występują razem z nimi w zdrowych i chorych organizmach.
W środowisku te cząstki są wykrywalne w glebie, powietrzu i wodzie. Badania metagenomiczne pokazują bogactwo sekwencji w każdym biotopie.
Endogenne elementy wirusowe w genomach gospodarza
Endogenne elementy wirusowe (EVE) to fragmenty genomu włączone w historii ewolucyjnej.
U ludzi około 8% genomu stanowią sekwencje HERV. Mogą one pełnić funkcje regulacyjne albo być neutralne.
- Rola ewolucyjna: integracja EVE czasami dostarcza nowych elementów regulacyjnych.
- Konsekwencje zdrowotne: część sekwencji może wpływać na ekspresję genów i odpowiedź immunologiczną.
- Współistnienie: zdrowe osoby często noszą wiele różnych cząstek jednocześnie, które mogą modulować mikrobiom.
„Monitorowanie środowiskowe i metagenomika pozwalają mapować wirom i szybko wykrywać nieznane sekwencje.”
Czy wirusy są żywe? Spór definicyjny i kryteria biologiczne
Klasyczne definicje życia napotykają na problemy, gdy stosujemy je do mikroskopijnych cząstek zakaźnych.
Argumenty przeciw: nie mają własnych układów metabolicznych ani samodzielnej reprodukcji. W świetle wielu zasad biologii nie spełniają kryteriów organizmów żywych, bo wymagają gospodarza, by się namnażać.
Argumenty za: posiadają genom, kodują białka i podlegają ewolucji. Te cechy pokazują, że w kontekście genetycznym i ewolucyjnym traktowanie ich jako jednostek aktywnych ma sens.
W praktyce naukowej wygodniejsze bywa funkcjonalne podejście oparte na cyklu replikacyjnym i interakcji z gospodarzem. To sposób, który może lepiej kierować badaniami, nauczaniem i oceną ryzyka.
„Debata ma znaczenie nie tylko filozoficzne — wpływa na nazewnictwo, bioetykę i strategie kontroli zakażeń.”
- Rozróżnienie wpływa na protokoły bezpieczeństwa w laboratoriach.
- Wybór ram pojęciowych kształtuje komunikację medyczną i edukację.
- Praktyczne decyzje często opierają się na funkcjonalnej definicji, a nie na filozoficznym konsensusie.
Zagrożenia biologiczne i CBRNE: wirusy jako czynniki chorobotwórcze i potencjalne narzędzia bioterrorystyczne
W scenariuszach CBRNE wirusy mogą prowadzić do gwałtownego obciążenia systemów opieki zdrowotnej. Szybka transmisja zwiększa ryzyko rozległych epidemii i dezorganizacji łańcuchów dostaw.
Drogi przenoszenia obejmują kontakt bezpośredni i pośredni, kropelkową i aerozolową transmisję. Wektory stawonogi oraz rezerwuary zwierzęce łączą kręgi zakażeń między gatunkami.
Mutageny chemiczne a materiał genetyczny
Chemiczne mutageny modyfikują strukturę DNA i RNA. Benzopiren i aflatoksyny tworzą addukty DNA, co może prowadzić do nowotworów.
Bromek etydyny i akrydyna interkalują w materiale genetycznym. Kwas azotowy deaminuje zasady, a metale ciężkie wywołują stres oksydacyjny.
Konsekwencje społeczne i prewencja
Skutki obejmują presję na szpitale, panikę i dezinformację. Kluczowe są nadzór epidemiologiczny, laboratoria referencyjne i protokoły dekontaminacji.
„Skoordynowana komunikacja ryzyka ratuje życie i ogranicza chaos.”
| Obszar | Ryzyko | Środki zaradcze |
|---|---|---|
| Transmisja | Szybkie rozprzestrzenianie | Nadzór, izolacja, PPE |
| Mutagenez | Nowotwory, zmiany dziedziczne | Monitorowanie środowiska, ograniczenie ekspozycji |
| Systemy społeczne | Dezinformacja, przerwy w łańcuchu | Komunikacja, zabezpieczenie łańcuchów dostaw |
Wirusy – od biologicznego zagrożenia do narzędzi genetycznych.
W praktyce naukowej wiele cząstek przechodzi transformację z problemu epidemiologicznego w użyteczne platformy badawcze.
Syntetyzujemy wnioski: badania nad ich cyklem życia i materiałem genetycznym umożliwiły stworzenie systemów, które mogą być projektowane jako nośniki genów, prezentatory antygenów oraz platformy selekcji molekularnej.
Takie rozwiązania mogą być używane w terapii genowej, szczepionkach wektorowych czy do ekranu bibliotek peptydowych.
Etyka i regulacje: stosowanie tych systemów wymaga oceny ryzyka, nadzoru oraz zgody komisji bioetycznych. Procedury przedkliniczne i kontrola biosafety są niezbędne.
Ważne: mechanizmy, które w naturze zagrażają zdrowiu, po modyfikacji służą medycynie. Postępy zależą od dokładnego rozumienia biologii i iteracyjnych testów w warunkach kontrolowanych.
„Bezpieczeństwo i odpowiedzialność naukowa muszą iść w parze z innowacją.”
- Platformy mogą dostarczać geny i prezentować antygeny.
- Ocena ryzyka i nadzór regulacyjny są kluczowe.
- Rozwój wymaga badań przedklinicznych i etycznych debat.
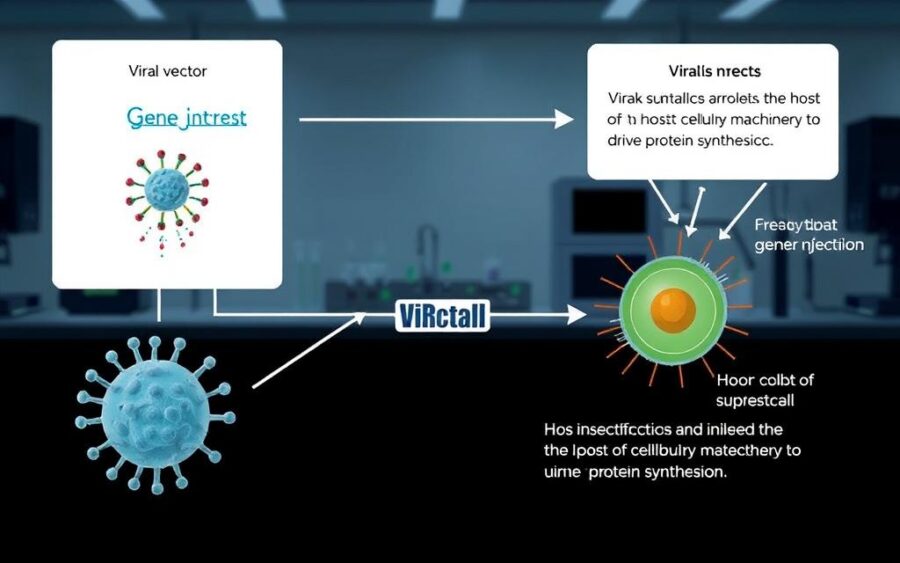
Wektory wirusowe w inżynierii genetycznej: zasady konstrukcji i bezpieczeństwo
W praktycznych zastosowaniach wybór między użyciem całego, zdezarmowanego wirusa a jedynie elementów regulacyjnych wpływa na efektywność i ryzyko. Całe cząstki mogą być silniejszym narzędziem transferu, ale wymagają szerokich zabezpieczeń. Alternatywnie, promotory, sygnały pakowania i enzymy wirusowe mogą być stosowane niezależnie.
Projektowanie i rodzaje wektorów
Projekt obejmuje modyfikacje sekwencji, regiony pakowania, promotory i systemy selekcji klonów. Kosmidy i fagmidy ułatwiają budowę bibliotek genomowych i cDNA, co przyspiesza badania funkcjonalne.
Bezpieczeństwo i ograniczenia
Dobre praktyki obejmują klasy BSL, mechanizmy split-genome oraz self-inactivation. Trzeba uwzględnić ograniczenia ładunku, tropizm i immunogenność, które mają wpływ na użycie w terapii i badania.
„Kompromis między wydajnością a bezpieczeństwem kształtuje każdy etap projektowania wektorów.”
| Aspekt | Całe cząstki | Elementy regulacyjne / plazmidy |
|---|---|---|
| Efektywność transferu | Wysoka | Umiarkowana |
| Bezpieczeństwo | Wymaga nadzoru BSL2/3 | Niższe ryzyko, łatwiejsza kontrola |
| Zastosowania | Terapia genowa, wektory onkolityczne | Biblioteki, ekspresja białek, badania |
| Ograniczenia | Immunogenność, tropizm, ładunek | Pojemność insercji, stabilność |
Systemy ekspresji białek oparte na wirusach: biologii molekularnej w praktyce
W praktyce biologii molekularnej układy faga T7 oferują precyzyjną kontrolę nad syntezą białek. Silny promotor T7 i jego specyficzna polimeraza umożliwiają szybkie uruchomienie transkrypcji w komórkach bakteryjnych.
Mechanika: promotor T7 jest bardzo aktywny, a polimeraza faga T7 rozpoznaje jedynie ten promotor. Taka separacja pozwala na ścisłą regulację ekspresji oraz minimalizuje tło.
Promotor T7 i elementy faga lambda
Elementy faga lambda dostarczają mechanizmów regulacyjnych i integracyjnych. Używa się ich tam, gdzie potrzebna jest kontrola włącz/wyłącz lub stabilna insercja.
Wektory ekspresyjne w przemyśle i badaniach białek
Zastosowania przemysłowe obejmują produkcję enzymów, antygenów referencyjnych i bioproduktów, które mogą wymagać precyzyjnej kontroli ekspresji.
- Dobór wektora uwzględnia sygnały sekrecji, tagi oczyszczania i ko-ekspresję chaperonów.
- Wyzwania to toksyczność produktu, agregacja i modyfikacje potranslacyjne; łagodzi się je przez kontrolę indukcji i temperatury.
- Optymalizacja obejmuje stężenie induktora, czas hodowli i warunki hodowli.
„Układy T7 i lambda łączą siłę ekspresji z mechanizmami regulacji, co czyni je fundamentem produkcji białek rekombinowanych.”
| Aspekt | Układ T7 | Elementy lambda |
|---|---|---|
| Główna funkcja | Silna, szybka ekspresja | Regulacja, integracja |
| Zastosowanie | Produkcja białek w E. coli | Stabilne insercje, przełączalne systemy |
| Typowe problemy | Toksyczność, agregacja | Kontrola poziomu, integracja w genomie |
Phage display: selekcja białek i przeciwciał w badaniach i przemyśle farmaceutycznym
Phage display wykorzystuje bakteriofagi jako platformę do prezentacji bibliotek peptydów i fragmentów przeciwciał.
Zasady metody i etapy selekcji
Biblioteki o wielomilionowej różnorodności są wyświetlane na powierzchni fagów. Selekcja polega na inkubacji z ligandom, usuwaniu niespecyficznych bindów i amplifikacji wiążących klonów.
Biopanning to iteracyjne rundy, które zwiększają powinowactwo i specyficzność. Następnie wybrane sekwencje waliduje się in vitro i w układach komórkowych.
Przykłady zastosowań
Metoda wspiera odkrywanie leków, projektowanie przeciwciał terapeutycznych dla ludzi oraz rozwój testów diagnostycznych. W przemyśle pozwala szybko identyfikować kandydatów, które mogą stać się leadami terapeutycznymi.
Zalety i ograniczenia
- Ogromna różnorodność bibliotek i szybka selekcja.
- Możliwość inżynierii miejscowej i humanizacji przeciwciał.
- Wady: artefakty wiązania, wybór tła i potrzeba NGS dla analizy populacji.
„Phage display łączy prostotę eksperymentu z mocą ewolucyjnej selekcji.”
Bakteriofagi jako diagnostyka i terapia: od ludzi po rolnictwo i przemysł
Specyficzność fagów względem szczepów bakteryjnych stwarza nowe możliwości terapeutyczne i kontrolne. Fagi atakują tylko wybrane bakterie, co zmniejsza efekt uboczny na mikrobiom.
Terapia przeciw patogenom bakteryjnym
W terapii fagowej stosuje się pojedyncze izolaty lub koktajle fagowe. Koktajle zwiększają zakres działania i ograniczają odporność.
Korzyść: skuteczność wobec szczepów opornych na antybiotyki. Kliniczne badania w Polsce i za granicą pokazują obiecujące wyniki w zakażeniach ran i układu moczowego.
Wykorzystanie w bezpieczeństwie żywności i biokontroli
Fagi służą wykrywaniu konkretnych szczepów i monitorowaniu skażeń w przemyśle spożywczym. Testy oparte na fagach bywają szybkie i selektywne.
W rolnictwie i hodowlach zwierząt stosuje się preparaty fagowe, aby ograniczać choroby bakteryjne bez stosowania masowych antybiotyków.
- Diagnostyka: szybkie testy punktowe i monitoring produkcji.
- Regulacje: kontrola czystości, stabilność produktu i standardy dawki są kluczowe.
- Biotechnologia: fagi mogą być wektory modyfikacji szlaków metabolicznych bakterii w zastosowaniach przemysłowych.
„Fagi łączą precyzję z elastycznością wdrożeń — od kliniki po linię produkcyjną.”
Wektory eukariotyczne i terapia genowa: transfer obcego DNA do komórek gospodarza
Wektory oparte na wirusach eukariotycznych służą do wprowadzania sekwencji terapeutycznych i modyfikowania funkcji komórek. W praktyce klinicznej najczęściej używa się AAV, lentawirusów oraz adenowirusów, które różnią się właściwościami.
Wybór wektora, tropizm komórek i kontrola ekspresji białek
AAV charakteryzuje się niską immunogennością i stabilną ekspresją w niektórych typach tkanek, ale ma ograniczoną pojemność ładunku.
Lentawirusy integrują materiał w genomie gospodarza, co zapewnia długotrwałą ekspresję, lecz może zwiększać ryzyko insercji genowej.
Adenowirusy oferują dużą pojemność i silną ekspresję, ale wywołują silniejsze reakcje immunologiczne.
Dobór promotora i elementów regulacyjnych decyduje o poziomie i tkankowym profilu produkcji białek. Projekt może uwzględniać promotory tkankowo-specyficzne, elementy insulatorowe i systemy indukcyjne.
Ryzyka, etyka i standardy bezpieczeństwa w zakresie terapii
Ocena ryzyka obejmuje integrację w genomie, potencjalną onkogenezę, rekombinację z endogennymi sekwencjami oraz odpowiedzi immunologiczne ludzi. Testy przedkliniczne i modele in vitro pomagają zredukować niepewność.
„Bezpieczeństwo pacjenta i rzetelna komunikacja etyczna są podstawą badań klinicznych.”
Standardy obejmują stosowanie odpowiednich poziomów BSL, projektowanie barier biologicznych (np. systemy self-inactivating) oraz uzyskanie zgód etycznych i świadomej zgody pacjentów.
| Wektor | Pojemność ładunku | Tropizm | Trwałość ekspresji | Immunogenność |
|---|---|---|---|---|
| AAV | ~4.7 kb | Tkankowo-specyficzny (serotypy) | Długotrwała (episomalna) | Niska |
| Lentawirusy | ~8–10 kb | Szeroki (dzieli wiele typów komórek) | Trwała (integracja) | Umiarkowana |
| Adenowirusy | >7.5 kb | Szeroki, efemeryczny | Krótkotrwała | Wysoka |
- Wybór wektora zależy od celu klinicznego, rodzaju komórek i profilu bezpieczeństwa.
- Protokoły BSL, monitoring immunologiczny i plan zarządzania ryzykiem są wymagane.
- Mierniki skuteczności to ekspresja transgenu, poprawa fenotypu oraz długoterminowe obserwacje bezpieczeństwa.
Szczepionki wektorowe i wirusy onkolityczne: nowa fala leczenia chorób
Nowoczesne terapie łączą mimikę wirusową z immunologią, tworząc platformy, które pobudzają układ odpornościowy i celują w komórki chorobowe.
Wirusy jako nośniki antygenów i wzmacnianie odpowiedzi immunologicznej
Szczepionki wektorowe wykorzystują bezpieczne, zmodyfikowane cząstki do dostarczenia genów kodujących antygeny.
Efekt: szybka indukcja odpowiedzi humoralnej i komórkowej u ludzi, często przy niższej dawce niż przy tradycyjnych metodach.
Bezpieczeństwo projektuje się przez usunięcie genów replikacji i zastosowanie serotypów o znanym profilu immunologicznym.
Onkoliza wirusowa i łączenie z immunoterapią
Wirusy onkolityczne selektywnie replikują się w komórkach nowotworowych. Powodują onkolizę i uwalniają antygeny nowotworowe, które wzmacniają odpowiedź immunologiczną.
Połączenie z inhibitorami punktów kontroli immunologicznej zwiększa efekt kliniczny, bo terapia uwalnia neoantygeny i jednocześnie znosi hamowanie limfocytów.
| Aspekt | Korzyść | Wyzwania |
|---|---|---|
| Konstrukcja | Brak replikacji, efekt immunogenny | Immunogenność wektora, limit pojemności |
| Użycie w epidemiach | Szybkie opracowanie szczepionek | Skalowanie produkcji, dystrybucja |
| Onkoliza + immunoterapia | Synergiczne odpowiedzi, możliwa dłuższa remisja | dobór biomarkerów, heterogeniczność guza |
Kluczowe elementy badań klinicznych to identyfikacja biomarkerów odpowiedzi, określenie punktów końcowych i monitoring długoterminowy.
W praktyce projekty muszą uwzględniać tolerancję immunologiczną, możliwość odporności na wektor oraz protokoły bezpieczeństwa, które mogą prowadzić do poprawy trwałości remisji.
„Integracja onkolizy z immunoterapią otwiera nowe drogi leczenia, wymagając równocześnie rygorystycznej oceny bezpieczeństwa.”
Wirusy w inżynierii materiałowej i nanotechnologii: funkcjonalne bionanomateriały
Kapsydy o regularnej symetrii stanowią precyzyjne rusztowania wykorzystywane w nanofabrykacji. Ich powtarzalna geometria ułatwia kontrolę rozmieszczenia elementów na poziomie nanometra.
Architektury kapsydów jako matryce w nanofabrykacji
Symetria i powtarzalność struktur umożliwiają osadzanie funkcjonalnych komponentów w regularnych wzorach. Dzięki temu można tworzyć układy przewodzące, katalityczne i sensoryczne o precyzyjnej architekturze.
Modyfikacje powierzchni białek kapsydu polegają na wprowadzeniu grup chemicznych lub peptydów kotwiczących. Takie zmiany pozwalają na powstanie hybrydowych materiałów, które mogą być przewodnikami prądu lub katalizatorami reakcji.
W praktyce zastosowania obejmują elementy w przemyśle takie jak sensory gazowe, katalizatory o dużej aktywności oraz nośniki leków o kontrolowanym uwalnianiu. Integruje się je często z technikami litografii miękkiej w celu skali produkcji.
Wyzwania to stabilność w warunkach eksploatacji, zachowanie jednorodności oraz skalowanie procesów. Trzeba też zapewnić zgodność biologiczną i długoterminową trwałość materiału.
„Bioinspirowane matryce proteinowe otwierają nowe możliwości dla elektroniki miękkiej i systemów dostarczania cząsteczek terapeutycznych.”
- Symetria kapsydów ułatwia nanofabrykację i precyzyjne rozmieszczenie komponentów.
- Modyfikacje powierzchni białek umożliwiają funkcjonalizację i tworzenie hybryd.
- Przykłady zastosowań: sensory, katalizatory i nośniki leków w przemyśle.
- Główne wyzwania: stabilność, jednorodność, skalowanie i biokompatybilność.
Wniosek
Wniosek
Końcowe wnioski łączą wiedzę o strukturze i cyklu życia z praktycznymi wynikami badań. Zrozumienie architektury oraz mechanizmów replikacji pozwala wyjaśnić rolę, jaką pełnią te cząstki w przyrodzie i medycynie.
Na tej podstawie powstają platformy, w których wirusy mogą być wykorzystywane jako wektory, szczepionki i systemy selekcji. Taka transformacja niesie ze sobą zarówno korzyści, jak i odpowiedzialność.
Bilans korzyści i ryzyka wiąże się z kontrolą bezpieczeństwa, regulacjami oraz etyczną oceną. Konieczne są dalsze badania, nadzór i przejrzyste procedury, które mogą się zmieniać wraz z postępem naukowym.
Zachęcamy do śledzenia aktualnych informacje i standardów. Tylko rzetelna wiedza oraz współpraca nauki, regulatorów i społeczeństwa zapewnią bezpieczne i skuteczne wdrożenia.
Czytaj także: Kontenery – jak jeden wynalazek zrewolucjonizował handel
